|
Revista Ciencias de la Actividad Física UCM, 23(1), enero - junio,
2022. ISSN: 0719-4013
Entrenamiento muscular inspiratorio en pacientes con insuficiencia cardíaca: una revisión de revisiones Inspiratory muscle training in patients with heart failure: a review of reviews 1 Bruno Bizzozero Peroni & 2 Valentina Díaz Goñi
Bizzozero, P., & Díaz, V. (2022). Entrenamiento muscular
inspiratorio en pacientes con insuficiencia cardíaca: una revisión de
revisiones. Revista Ciencias de la Actividad Física UCM, 23(1),
enero-junio, 1-16. https://doi.org/10.29035/rcaf.23.1.4
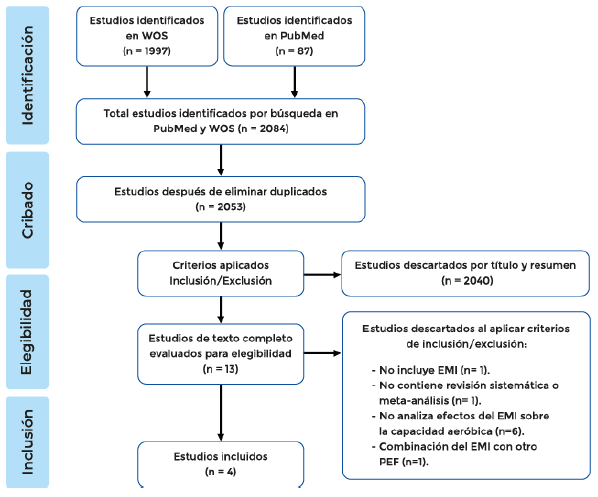
RESUMEN El objetivo de esta revisión fue conocer la influencia del entrenamiento muscular inspiratorio (EMI) sobre la capacidad aeróbica y la fuerza muscular inspiratoria (FMI) en pacientes con insuficiencia cardíaca (IC). Realizamos una revisión de revisiones sistemáticas en PubMed y Web of Science hasta agosto de 2019. Se identificaron un total de 2053 artículos, de los cuales 4 se seleccionaron para esta revisión. Se utilizó la herramienta ‘Assessment of Multiple Systematic Reviews 2’ (AMSTAR-2) para evaluar la calidad de los estudios. En los estudios incluidos se examinaron un total de 10 intervenciones diferentes con 250 pacientes (rango edad media= 53-76 años). Todos los estudios presentaron nivel de confianza alto (AMSTAR-2). El EMI presentó mejoras significativas sobre la capacidad aeróbica (test de la marcha de 6 minutos: 46.66-71.04 metros; p<0.05 y VO2pico: 2.59-2.65 mL/kg-1/min-1; p<0.01) y la FMI (presión inspiratoria máxima: 16.57-23.36 cmH2O, p<0.05) en comparación al grupo control. Programas de intervención de EMI con una duración de 12 semanas reportaron mayores mejorías sobre la capacidad aeróbica y la FMI en comparación a programas de intervención de menor duración. El EMI es un tratamiento importante y necesario en la rehabilitación cardíaca de pacientes con IC. Son necesarios más estudios que analicen los efectos de diferentes rangos en las características del EMI. Palabras clave: ejercicio, ejercicios respiratorios, Insuficiencia cardíaca, rehabilitación cardíaca. ABSTRACT The aim of this review was to understand the influence of inspiratory muscle training (IMT) on aerobic capacity and inspiratory muscle strength (IMS) in patients with heart failure (HF). We conducted a review of systematic reviews in PubMed and Web of Science up to August 2019. A total of 2053 articles were identified, of which 4 were selected for this review. The ‘Assessment of Multiple Systematic Reviews 2’ (AMSTAR-2) tool was used to assess the quality of the studies. In the included studies, a total of 10 different interventions with 250 patients (mean age range = 53-76 years) were examined. All the studies presented high confidence level (AMSTAR-2). IMT showed significant improvements in aerobic capacity (6-minute walk test: 46.66-71.04 meters; p<0.05 and VO2peak: 2.59-2.65 mL/kg-1/min-1; p<0.01) and IMS (maximal inspiratory pressure: 16.57-23.36 cmH2O, p<0.05) in this population compared to the control group and IMF in this population. IMT intervention programs lasting 12 weeks reported greater improvements in aerobic capacity and IMS compared to shorter intervention programs. IMT is an important and necessary treatment in cardiac rehabilitation of patients with HF. More studies are needed to analyze the effects of different ranges of the IMT characteristics. Key words: Exercise, breathing exercises, heart failure, cardiac rehabilitación. 1 Instituto Superior de Educación Física, Universidad de la República. Rivera, Uruguay. https://orcid.org/0000-0003-0614-5561 | brunobpru@gmail.com 2 Instituto Superior de Educación Física, Universidad de la República. Montevideo, Uruguay. https://orcid.org/0000-0002-1724-1893| valediazgoni@gmail.com INTRODUCCIÓN La insuficiencia cardíaca (IC) presenta una prevalencia mundial mayor a 37 millones de personas, con un pronóstico de aumento de estas cifras especialmente en adultos mayores (Ziaeian & Fonarow, 2016). La IC es un síndrome clínico caracterizado por síntomas típicos (por ejemplo, disnea, debilidad, poca tolerancia al ejercicio) que pueden estar acompañados por signos (por ejemplo, presión venosa yugular elevada, crepitantes pulmonares, edema periférico) causados por una anomalía cardíaca estructural y/o funcional, que resulta en un gasto cardíaco reducido y/o presiones intra-cardíacas elevadas (Ponikowski et al., 2016). Los pacientes con IC encuentran afectados su bienestar psicosocial, calidad de vida, capacidad funcional y función cardíaca (Ponikowski et al., 2016). La rehabilitación cardíaca (RC) refiere a tratamiento fundamental en la IC (Task Force Members et al., 2013), mejorando el pronóstico de la enfermedad en (Ponikowski et al., 2016). El entrenamiento muscular inspiratorio (EMI) es una intervención efectiva en la RC para pacientes con IC (Martínez et al., 2001; Smart et al., 2013). Se considera un tratamiento complementario al programa de ejercicio físico (PEF) y tratamiento farmacológico, asociándose con mejoras en síntomas de la IC como la intolerancia al ejercicio, disnea o debilidad muscular inspiratoria (Arena et al., 2010; Martínez et al., 2001). El EMI utiliza resistencia progresiva para proporcionar cargas a los músculos inspiratorios y lograr un efecto de fortalecimiento (Bissett et al., 2012). La carga del EMI se establece a través de la presión inspiratoria máxima (PIM) (Bissett et al., 2012; Wilches-Luna et al., 2016). La PIM es la medida más común de la fuerza muscular inspiratoria (FMI) y está asociada con la severidad de la IC y con la limitación ventilatoria durante el ejercicio en estos pacientes (Chua et al., 1995; Evans et al., 1995). La PIM se mide a nivel de la boca pidiéndole a la persona que tome una inspiración máxima mientras se encuentra en volumen residual y se mantiene durante al menos un segundo (Giallauria et al., 2018). Según la relación fuerza-longitud, cuanto mayor sea la longitud de reposo del diafragma o cuanto menor sea el volumen pulmonar, mayor será la PIM (Giallauria et al., 2018). Esta medida es independiente del flujo respiratorio del paciente y es altamente reproducible (Giallauria et al., 2018). En la actualidad los tipos de dispositivos más comunes para realizar el EMI son los dispositivos mecánicos de umbral de presión y los dispositivos electrónicos de carga resistiva (Lin et al., 2012). En el primero los pacientes desarrollan abruptamente una presión por encima de un valor umbral fijo sin sostener la presión en el tiempo, y en el segundo los pacientes mantienen la presión en el tiempo y entrenan hasta el rango inspiratorio final (Lin et al., 2012). El EMI se asoció con mejoras sobre la capacidad aeróbica y la FMI, siendo importantes indicadores de pronóstico y supervivencia en personas con IC (Myers et al., 2002; Smart et al., 2013; Wisløff et al., 2007). Sin embargo, el EMI no ha sido un programa de intervención muy utilizado en la RC de pacientes con IC (Dall’Ago et al., 2006; Ribeiro et al., 2009). A su vez, se establecen diferentes protocolos de intervención, siendo incierto qué rango de las características del EMI son más eficientes en la prevención secundaria de esta población (Arena et al., 2010). El objetivo de esta revisión es analizar la eficacia del EMI y sus características de prescripción sobre la capacidad aeróbica y la fuerza muscular inspiratoria en pacientes con IC. MÉTODO Este resumen de revisiones sistemáticas se realizó de acuerdo con las recomendaciones de la Colaboración Cochrane (Becker & Oxman, 2011; Smith et al., 2011). Este enfoque se recomienda cuando se intenta resumir, sintetizar y comparar resultados de la investigación de revisiones sistemáticas para proporcionar evidencia relevante a los tomadores de decisiones clínicas (Smith et al., 2011). Debido a la heterogeneidad significativa dentro de las revisiones sistemáticas incluidas, no se compararon los efectos agrupados y se proporcionan resultados más bien descriptivos. Estrategia de búsqueda Se aplicó la estrategia de búsqueda hasta el 5 de agosto de 2019 en las bases de datos PubMed y Web of Science. Se incluyeron revisiones sistemáticas y/o meta-análisis que analizaran los efectos del EMI sobre la capacidad aeróbica y la FMI en personas con IC. Para la búsqueda en PubMed se utilizaron los términos MeSH (Medical Subject Heading) para definir la enfermedad y la intervención: ‘heart failure’ [MeSH] AND ‘breathing exercises’ [MeSH] OR ‘exercise therapy’ [MeSH] OR ‘exercise’ [MeSH] OR ‘cardiac rehabilitation’ [MeSH]. En los términos MeSH ‘breathing exercises’, ‘exercise therapy’ y ‘exercise’ se utilizó la opción restringir al tema principal como función de búsqueda. A su vez, se seleccionaron otros criterios para la búsqueda: estudios de revisiones sistemáticas y/o meta-análisis, publicados en inglés o español, a texto completo, y en población humana. La búsqueda en Web of Science se realizó con palabras claves para definir patología, intervención, idioma del estudio y tipo de artículo: ‘inspiratory muscle training’ OR ‘breathing exercises’ OR ‘respiratory exercise’ AND ‘heart failure’ AND ‘english’ OR ‘spanish’ AND ‘review’. Criterios de inclusión/exclusión Los estudios debían cumplir los siguientes criterios de inclusión: (1) que analicen la influencia del EMI sobre la capacidad aeróbica y/o la FMI en personas con IC; (2) en inglés o español a texto completo; y, (3) en modalidad de revisión sistemática y/o meta-análisis. Los criterios de exclusión fueron los siguientes: (1) estudios sobre pacientes cardíacos que no incluyan IC; (2) investigaciones que no expresen resultados específicos sobre la capacidad aeróbica o la FMI; (3) revisiones que sus resultados sean la combinación de EMI con algún tipo de PEF; (4) estudios cuyos resultados sean la combinación de IC con otra patología; y, (5) artículos que expresen resultados en base a estudios en animales. Identificación de estudios Al realizar la estrategia de búsqueda se identificaron 2084 artículos. La figura 1 muestra el diagrama de flujo según la declaración ‘Preferred Reporting Items for Systematic Reviews and Meta-Analyses’ (PRISMA) (Moher et al., 2009). Dos revisores (BBP y VDG) realizaron el siguiente procedimiento de selección: (1) fase de cribado en título y resumen; (2) búsqueda de texto completo y evaluación de elegibilidad de los estudios seleccionados. Se buscaron las listas de referencias de los artículos incluidos para identificar otros posibles estudios a ser incluidos. Finalmente, un total de 4 artículos cumplieron con los criterios de inclusión/exclusión. Extracción de datos Dos revisores (BBP y VDG) recopilaron los datos que incluyeron: tipo de estudio, características de las intervenciones incluidas en cada estudio (años de búsqueda, cantidad, tipo y calidad), características de los pacientes (cantidad, edad, clasificación de la enfermedad, porcentaje de fracción de eyección del ventrículo izquierdo, presión inspiratoria máxima y medicación), características del EMI (frecuencia, duración, intensidad, tipo, volumen, supervisión, eventos adversos), resultados del EMI sobre la capacidad aeróbica y la FMI, y resultados de los efectos de las características del EMI analizadas sobre estas variables. Evaluación de la calidad de los estudios Se utilizó la herramienta ‘Assessment of Multiple Systematic Reviews 2’ (AMSTAR-2) para evaluar la calidad metodológica de los estudios incluidos. Este instrumento ha sido validado para la evaluación crítica de revisiones sistemáticas que incluyan ensayos aleatorizados y no aleatorizados (Shea et al., 2017). AMSTAR-2 contiene 16 dominios con opciones de respuesta: ¨si¨ (resultado es positivo), ¨si parcial¨ (adherencia parcial al estándar), o ¨no¨ (no se cumplió el estándar) (Shea et al., 2017). 7 dominios son considerados críticos (dado que pueden afectar sustancialmente la validez de una revisión y sus conclusiones, y 9 dominios son considerados no críticos (ver Tabla 1). De las debilidades en estos dominios surgen cuatro niveles de confianza: alta (ninguna debilidad crítica y hasta una no crítica), moderada (ninguna debilidad crítica y más de una debilidad no crítica), baja (hasta una debilidad crítica, con o sin debilidades no críticas) y críticamente baja (más de una debilidad crítica, con o sin debilidades no críticas) (Shea et al., 2017). Ambos autores (BBP y VDG) realizaron la evaluación metodológica de los estudios utilizando la lista de verificación en línea de la herramienta AMSTAR-2 (Shea et al., 2017). La Tabla 1 resume esta información. RESULTADOS Características de los estudios incluidos Se descartaron 2040 estudios al aplicar criterios de inclusión/exclusión al título y resumen (Figura 1). Del total de 13 estudios de texto completo evaluados para elegibilidad, se excluyeron 9 al aplicar criterios de inclusión/exclusión. En total se incluyeron 4 estudios identificados en la búsqueda de las bases de datos PubMed y Web of Science (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018).
Figura 1. Diagrama de flujo según PRISMA para la selección de
revisiones sistemáticas y meta-análisis.
La Tabla 1, indica los niveles de confianza de las revisiones sistemáticas y meta-análisis incluidos a través de la herramienta AMSTAR-2. Los estudios incluidos presentaron nivel de confianza alto (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Un resumen de las características de los estudios incluidos se presenta en la Tabla 2. Los 4 estudios contienen revisiones sistemáticas y meta-análisis. Todos los estudios analizaron los efectos del EMI sobre la capacidad aeróbica y la FMI en pacientes adultos (rango edad media: 53-76 años) con IC y fracción de eyección del ventrículo izquierdo (FEVI) reducida (<40%) (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). En los estudios incluidos e examinaron un total de 10 intervenciones diferentes con 250 pacientes con IC tipo I, II y III según la clasificación funcional New York Heart Association (NYHA) (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). En 9 de estas 10 intervenciones, se detalló la clasificación NYHA, con un total de 8 pacientes clase I, 137 pacientes clase II y 102 pacientes clase III (Gomes et al.; 2018, Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). La presión inspiratoria máxima (PIM) de los pacientes antes de la intervención, se detalló en 3 estudios y osciló entre 46.5-84.2 cmH2O (Gomes et al., 2018; Montemezzo et al., 2014; Sadek et al., 2018). Ningún estudio reportó la medicación utilizada por los pacientes (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Los resultados sobre la capacidad aeróbica se determinaron a través del consumo de oxígeno pico (VO2pico) y el test de la marcha (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Los resultados sobre la FMI se establecieron a través de la PIM (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). En cuanto a las características del EMI, se realizó análisis de la intensidad, el dispositivo utilizado y la duración del programa de entrenamiento (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012). La calidad metodológica de las intervenciones incluidas en los estudios se reportó como buena según la herramienta ‘Physiotherapy Evidence Database’ (PEDro) (Gomes et al., 2018; Montemezzo et al., 2014; Sadek et al., 2018). Además, en 2 estudios se reportó una calidad de la evidencia baja o muy baja de las variables analizadas, basada en las limitaciones del diseño de las intervenciones, imprecisión e inconsistencia de los resultados a través de la herramienta ‘Grading of Recommendations Assessment, Development and Evaluation’ (GRADE) (Gomes et al., 2018; Plentz et al., 2012). En todas las variables que analizaron estos 2 estudios se reportó una calidad de la evidencia baja o muy baja, basada en las limitaciones del diseño de las intervenciones, imprecisión e inconsistencia de los resultados (Gomes et al., 2018; Plentz et al., 2012). Características de las intervenciones en los estudios incluidos Las características del entrenamiento vienen incluidas en la tabla 3. Todos los estudios especificaron la frecuencia semanal, duración del programa, intensidad y tiempo de sesión del EMI (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). La duración del EMI osciló entre 4-12 semanas, la frecuencia entre 3-14 sesiones semanales, y el tiempo de sesión entre 10-90 minutos o hasta la fatiga respiratoria (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). El rango de intensidades del EMI osciló entre 15-60% de la PIM (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). El EMI se realizó con dispositivos mecánicos de umbral de presión y con dispositivos electrónicos de carga resistiva (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Las series y repeticiones del EMI no se reportó en ningún estudio (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Tabla 1 Evaluación de la calidad metodológica (AMSTAR-2) de revisiones sistemáticas y meta-análisis incluidos.  A: Alta; C: Confianza. AMSTAR-2 contiene 7 dominios críticos (ítems 2, 4, 7, 9, 11, 13, 15) y 9 dominios no críticos que pueden ser calificados como ¨si¨, ¨si parcial¨ (S/P), ¨no¨, o ¨no aplica¨ (N/A) Shea et al., 2017 y Ciapponi, 2018 establecen las preguntas de los dominios/ítems de AMSTAR-2. Fuente: Elaboración propia. Todos los estudios compararon el EMI con un grupo control (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). El grupo control se estableció con una intensidad baja de la carga inspiratoria (15% PIM) o sin carga inspiratoria (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Dos estudios especificaron la supervisión del EMI para 9 de las 10 intervenciones diferentes incluidas en los estudios (Gomes et al., 2018; Montemezzo et al., 2014). En 5 intervenciones se reportó la supervisión del EMI para todas las sesiones semanales y en 4 intervenciones se reportó la supervisión del EMI para una sesión semanal (Gomes et al., 2018; Montemezzo et al., 2014). Efectos del entrenamiento muscular inspiratorio sobre la capacidad aeróbica y la fuerza muscular inspiratoria Los resultados de los estudios incluidos sobre la capacidad aeróbica y la FMI se presentan en la Tabla 4. En cuanto a la capacidad aeróbica, tres estudios reportaron resultados sobre el VO2pico (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012), tres estudios detallaron resultados sobre el test de la marcha de 6 minutos (Gomes et al., 2018), y un estudio efectuó un mismo análisis para test de la marcha de 6 y 12 minutos (Gomes et al., 2018). Programas de intervención de EMI se asociaron a mejoras significativas sobre el VO2pico en 2 estudios, con incrementos entre 2.59-2.65 mL/kg-1/min-1 (Gomes et al., 2018; Montemezzo et al., 2014). Un estudio reportó mejoras no significativas sobre el VO2pico, con incrementos de 1.98 mL/kg-1/min-1 (Plentz et al., 2012). Programas de intervención de EMI se asociaron a mejoras significativas sobre el test de la marcha de 6 minutos en 3 estudios, con incrementos entre 46.66-71.04 metros (Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Además, un estudio reportó mejoras significativas sobre test de la marcha de 6 y 12 minutos a través de la diferencia de medias estandarizada (SMD 1.71) (Gomes et al., 2018). A su vez, un estudio realizó análisis diferenciando pacientes con FMI débil y FMI normal (Montemezzo et al., 2014). Programas de intervención de EMI para pacientes con IC y FMI débil se asociaron a mejoras significativas sobre el VO2pico (4.00 mL/kg/min) y el test de la marcha de 6 minutos (80.00 metros) (Montemezzo et al., 2014). Programas de intervención de EMI para pacientes con IC y FMI normal se asociaron a mejoras significativas sobre el VO2pico (1.57 mL/kg/min) y a mejoras no significativas sobre el test de la marcha de 6 minutos (23.66 metros) (Montemezzo et al., 2014). En cuanto a la FMI, los cuatro estudios incluidos reportaron resultados sobre la PIM (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Programas de intervención de EMI se asociaron a mejoras significativas sobre la PIM en los 4 estudios, con incrementos entre 16.57-23.36 cmH2O (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Además, un estudio reportó mejoras significativas sobre la PIM sostenida al utilizar dispositivos electrónicos de carga resistiva, con incrementos de 144.74 cmH2O x 103s (Montemezzo et al., 2014). A su vez, programas de intervención de EMI para pacientes con IC y FMI débil se asociaron a mejoras significativas sobre la PIM, con incrementos de 31.87 cmH2O (Montemezzo et al., 2014). Programas de intervención de EMI para pacientes con IC y FMI normal reportaron mejoras significativas sobre la PIM, con incrementos de 14.72 cmH2O (Montemezzo et al., 2014). Tabla 2 Características de los estudios incluidos. 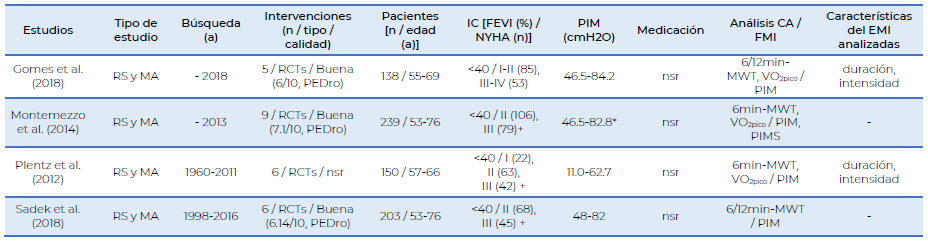 a: años; CA: capacidad aeróbica; cmH2O: centímetros de agua; FEVI: fracción de eyección del ventrículo izquierdo; FMI: fuerza muscular inspiratoria; IC: insuficiencia cardíaca; MA: meta-análisis; min: minutos; MWT: test de la marcha; n: cantidad; nsr: no se reporta; NYHA: New York Heart Association; PEDro: Physiotherapy Evidence Database; PIM: presión inspiratoria máxima; PIMS: presión inspiratoria máxima sostenida; RCT: ensayo controlado aleatorio; RS: revisión sistemática; VO2pico: consumo de oxígeno pico. + No se detalló el número de pacientes según la clasificación NYHA en todas las intervenciones incluidas. * Se realiza análisis sobre las variables según pacientes con fuerza muscular inspiratoria débil (<60 cmH2O) y pacientes con fuerza muscular inspiratoria normal (>60 cmH2O). Tabla 3 Características del entrenamiento en los estudios incluidos.  EA: eventos adversos; EMI: entrenamiento muscular inspiratorio; min: minutos; nsr: no se reporta; PIM: presión inspiratoria máxima; rep: repeticiones; sem: semanas; sp: sin progresión; ss: sesiones semanales. + No todas las intervenciones lo detallan. Tabla 4 Resultados de los estudios incluidos sobre la capacidad aeróbica y la fuerza muscular inspiratoria. 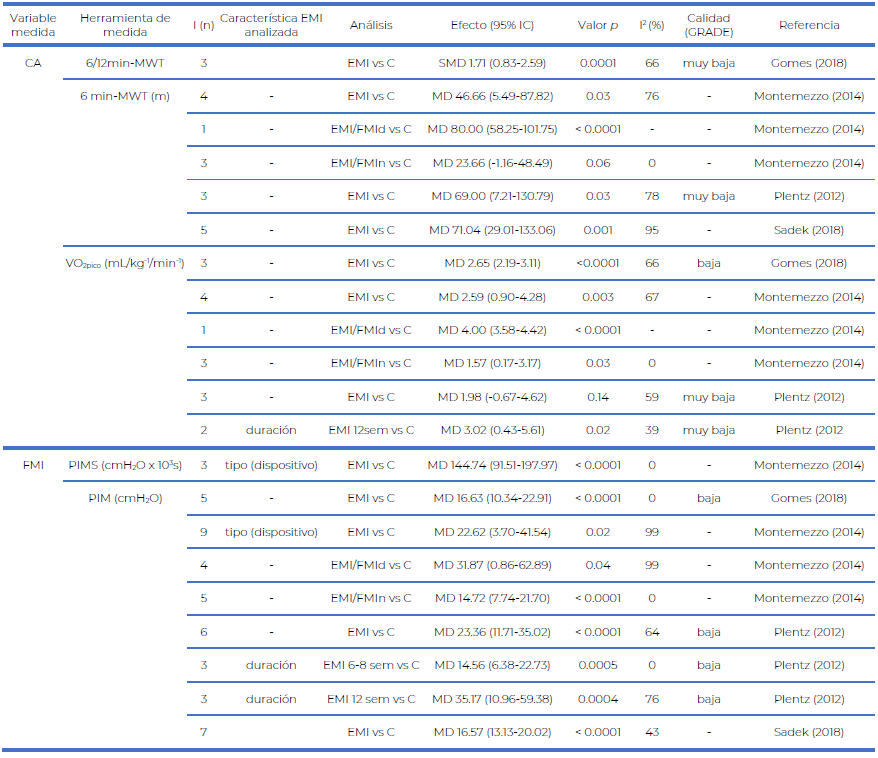 C: control; CA: capacidad aeróbica; cmH2O: centímetros de agua; EMI: entrenamiento muscular inspiratorio; FMI: fuerza muscular inspiratoria; FMId: fuerza muscular inspiratoria débil; FMIn: fuerza muscular inspiratoria normal; GRADE: Grading of Recommendations Assessment, Development and Evaluation; I: intervención; I2: heterogeneidad; IC: intervalo de confianza; kg: kilogramos; m: metros; MD: diferencia de las medias; min: minutos; MICT: entrenamiento continuo de moderada intensidad; min: minutos; mL: mililitros; MWT: test de la marcha; n: cantidad; PIM: presión inspiratoria máxima; PIMS: presión inspiratoria máxima sostenida; sem: semanas; SMD: diferencia de las medias estandarizada; VO2pico: consumo de oxígeno pico. Efectos de las características del entrenamiento muscular inspiratorio sobre la capacidad aeróbica y la fuerza muscular inspiratoria Los resultados de los efectos de las características del EMI sobre la capacidad aeróbica y la FMI en los estudios incluidos se presentan en la Tabla 4. En cuanto a la duración, programas de intervención de EMI con una duración de 12 semanas se asociaron a mejoras significativas sobre el VO2pico (3.02 mL/kg/min) mientras que programas de intervención de EMI con una duración entre 6-12 semanas se asociaron a mejoras no significativas (1.98 mL/kg/min) (Plentz et al., 2012). Además, programas de intervención de EMI con una duración de 12 semanas reportaron mayores mejorías sobre la PIM (35.17 cmH2O) que programas de intervención de EMI con una duración entre 6 y 8 semanas (14.56 cmH2O) (Plentz et al., 2012). A su vez, programas de intervención de EMI que utilizaron dispositivos mecánicos de umbral de presión reportaron mejoras significativas sobre la PIM (22.62 cmH2O) y programas de intervención de EMI que utilizaron dispositivos electrónicos de carga resistiva reportaron mejoras significativas sobre la PIM sostenida (144.74 cmH2O x 103s) (Montemezzo et al., 2014). DISCUSIÓN El objetivo de este resumen de revisiones sistemáticas y meta-análisis fue analizar la eficacia del EMI y sus características de prescripción sobre la capacidad aeróbica y la FMI en pacientes con IC. Programas de intervención de EMI reportaron mejoras significativas sobre el VO2pico en pacientes con IC y FEVI reducida, con incrementos que oscilaron entre 2.59 y 2.65 mL/kg-1/min-1 en comparación al grupo control (Gomes et al., 2018; Montemezzo et al., 2014). La magnitud de estos incrementos son clínicamente relevantes ya que por cada 1 mL/kg/min de incremento del VO2pico se reportaron reducciones del 15% sobre el riesgo de mortalidad por toda causa y mortalidad cardiovascular en esta enfermedad (Pattyn et al., 2014). A su vez, mejoras modestas sobre el VO2pico presentaron beneficios funcionales y de pronóstico en esta población (Kavanagh et al., 2002; Swank et al., 2012). Por cada 6% de incremento del VO2pico se redujo un 5% el riesgo de mortalidad por toda causa (Swank et al., 2012). Resulta fundamental atender esta variable en la RC, ya que el síntoma crónico primario en pacientes con IC es una menor tolerancia al ejercicio a través del descenso del VO2pico, afectando su calidad de vida, capacidad funcional, función cardíaca y esperanza de vida (Haykowsky et al., 2016; Ponikowski et al., 2016). La capacidad aeróbica a través del VO2pico se relaciona independientemente con el pronóstico de la enfermedad (Agostoni et al., 2013). Se han encontrado algunas explicaciones para la mejora de la capacidad aeróbica en pacientes con IC después de programas de intervención con EMI. Las biopsias de diafragma han demostrado una variedad de anormalidades histológicas en esta población (Callegaro et al., 2010). El EMI probablemente revierte algunos de los cambios histopatológicos encontrados en la musculatura inspiratoria de pacientes con IC (Callegaro et al., 2010). A su vez, el EMI podría reducir el metabolismo anaeróbico y mejorar la FMI, retrasando la fatiga muscular respiratoria y el reflejo metabólico (Chiappa et al., 2008). De esta forma se producirían mejoras en la ventilación por minuto y en el consumo máximo de oxígeno (Chiappa et al., 2008). Existe una correlación entre la FMI y la capacidad aeróbica, lo que sugiere que la FMI es un determinante importante de la tolerancia al ejercicio en personas con IC (Bard et al., 2008). Además, la mayor capacidad de ejercicio observada después del EMI podría ser causada por una mayor capacidad aeróbica de los músculos inspiratorios (Montemezzo et al., 2014). Los músculos inspiratorios aumentan sus enzimas oxidativas y cambian sus proporciones de tipo de fibra en respuesta al EMI (Ramirez-Sarmiento et al., 2002). Una capacidad aeróbica mejorada de los músculos inspiratorios podría retrasar la acumulación de metabolitos en pacientes con IC de una de manera similar a lo observado en personas sanas después del EMI (Witt et al., 2007). Estos cambios podrían explicar las mejoras sobre el test de la marcha de 6 minutos y el VO2pico luego de programas de intervención con EMI en pacientes con IC (Montemezzo et al., 2014). En esta revisión se encontró que programas de intervención de EMI reportaron mejoras significativas sobre la PIM en pacientes con IC y FEVI reducida, con incrementos que oscilaron entre 16.57 y 23.36 cmH2O en comparación al grupo control (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Estudios anteriores observaron que la PIM se encuentra reducida en la mayoría de personas con IC y que el EMI presentó efectos beneficiosos sobre la FMI (Mancini et al., 1995; Plentz et al., 2012). Las mejoras en la FMI podrían lograr la descarga respiratoria con la restauración del equilibrio entre la capacidad de los músculos inspiratorios para mantener la actividad y las cargas inspiratorias (Plentz et al., 2012). La debilidad muscular respiratoria contribuye a una capacidad aeróbica deteriorada en esta población (Wong et al., 2011). Pero existe evidencia de que la FMI débil observada en pacientes con IC es reversible (Plentz et al., 2012). Un estudio incluido en esta revisión encontró mejoras significativas en los efectos del EMI sobre la FMI de pacientes con debilidad muscular inspiratoria (Montemezzo et al., 2014). Sólo un estudio realizó análisis según pacientes con FMI débil y FMI normal. Si bien se reportaron mejoras significativas del EMI sobre la capacidad aeróbica y la FMI en ambos tipos de pacientes, se encontraron mayores mejorías en pacientes con FMI débil (Montemezzo et al., 2014). Estos resultados enfatizan la necesidad de incluir la evaluación del músculo inspiratorio como parte de la evaluación de la IC para indicar el tratamiento adecuado (Cahalin et al., 2013). De esta forma el EMI podría establecerse como parte obligatoria de la RC en pacientes con FMI débil y como parte complementaria en pacientes con FMI normal (Cahalin et al., 2013). Las mejoras en la RC de pacientes con IC dependen de diversos elementos como las características del entrenamiento, edad de los pacientes, severidad de la enfermedad o tratamiento médico, entre otros (Höllriegel et al., 2016). Los estudios incluidos presentaron gran variabilidad en estos elementos, sin analizar su incidencia en los efectos del PEF (Gomes et al., 2018; Montemezzo et al., 2014; Plentz et al., 2012; Sadek et al., 2018). Hay una necesidad de evaluar la influencia de estos elementos y el riesgo de eventos adversos, dado que los efectos del entrenamiento tienen relación con estos elementos (Giannitsi et al., 2019). En cuanto a las características del EMI solo se analizaron 2 elementos, la duración y el tipo de dispositivo utilizado. Programas de intervención de EMI con una duración de 12 semanas presentaron mayores mejorías sobre la capacidad aeróbica y la PIM en comparación a programas de intervención de menor duración (Plentz et al., 2012). En este estudio se encontró que la duración es en parte responsable de los efectos beneficiosos del EMI sobre la capacidad aeróbica y la FMI en pacientes con IC (Plentz et al., 2012). Las mejoras en programas de intervención de EMI con una duración de 12 semanas se pueden atribuir al retraso en el desarrollo de la fatiga diafragmática en pacientes con IC (Giannitsi et al., 2019; Swank et al., 2012). Esto lleva a una reducción en el reclutamiento de músculos accesorios de la respiración, aumentando la eficiencia ventilatoria y/o reduciendo el flujo sanguíneo requerido por los músculos respiratorios durante el ejercicio (Giannitsi et al., 2019; Swank et al., 2012). De esta forma se reduce la activación simpática y se mejora la vasodilatación sistémica, la perfusión de los músculos periféricos y la capacidad funcional (Giannitsi et al., 2019; Swank et al., 2012). Se han informado alteraciones estructurales y bioquímicas del músculo del diafragma, incluida una mayor proporción de fibras tipo I, fibras tipo IIb reducidas y atrofia de las fibras debido al aumento crónico de la carga del diafragma y la miopatía sistémica (Wong et al., 2011). De esta forma se produce una reducción en la FMI y un deterioro en la función muscular del diafragma para pacientes con IC (Le Jemtel & Mancini, 2011). Debido a esto el diafragma no puede proporcionar una ventilación adecuada, lo que lleva al reclutamiento de los músculos accesorios (Sarkar et al., 2019). Los músculos accesorios de la respiración incluyen los músculos esternocleidomastoideo, escaleno, trapecio, intercostal interno y abdominal (Sarkar et al., 2019). Una función muscular del diafragma deteriorada representa debilidad muscular inspiratoria y predice la intolerancia al ejercicio en esta población (Miyagi et al., 2018). En cuanto al tipo de dispositivo utilizado, se encontraron mejoras significativas sobre la PIM con dispositivos mecánicos de umbral de presión y sobre la PIM sostenida con dispositivos electrónicos de carga resistiva (Montemezzo et al., 2014). Al realizar el EMI con dispositivos mecánicos de umbral de presión los pacientes deben desarrollar bruscamente una presión por encima de un valor umbral fijo (% PIM) y no mantener la presión en el tiempo, debido a que la válvula de apertura cierra a presiones por debajo del umbral establecido (generalmente en el punto medio inspiratorio) (Sadek et al., 2018). De esta forma se inhibe el entrenamiento de los pacientes en el rango inspiratorio completo (especialmente a intensidades de entrenamiento más altas) (Sadek et al., 2018). Sin embargo, el EMI con dispositivos electrónicos de carga resistiva permite a los pacientes mantener la presión en el tiempo y entrenar hasta el rango inspiratorio final incluso a altas intensidades de entrenamiento (Sadek et al., 2018). La medición de la PIM sostenida puede ser más importante y específica para evaluar el músculo inspiratorio en comparación a la medición de la PIM (Montemezzo et al., 2014). Por lo tanto, aumentar la resistencia de los músculos respiratorios es igual o más importante que aumentar la fuerza porque se demostró que la PIM sostenida está más deteriorada en comparación con la PIM en pacientes con IC (Laoutaris et al., 2016). En esta revisión se encontró un análisis deficiente de los efectos de diferentes características del EMI, por lo que continúa siendo un desafío su prescripción más beneficiosa (Vanhees et al., 2012). Para determinar el programa de intervención de EMI más efectivo, es necesaria mayor información sobre la contribución de las distintas características del entrenamiento en la mejora de la capacidad aeróbica y la FMI en pacientes con IC. Esto adquiere suma importancia para un desafío importante de los programas de intervención de EMI, que es su aplicación en la RC de esta población. A su vez, resulta importante evaluar los efectos del EMI en combinación con otro tipo de PEF, ya que se ha postulado que un entrenamiento aeróbico, respiratorio y de fuerza combinados podría generar mayores beneficios fisiopatológicos y funcionales (Laoutaris, 2018). Principales limitaciones La búsqueda de estudios publicados en dos idiomas y en dos bases de datos fue una de las principales limitaciones de esta revisión, incluyendo un número reducido de artículos. Otra limitación de este estudio es la incapacidad de agrupar los resultados y comparar según diferentes características del entrenamiento ya que no fueron analizadas en los estudios incluidos. A su vez, esta revisión es limitada porque los estudios incluidos no incluyeron en el análisis aspectos importantes como el tratamiento farmacológico, etapa de la enfermedad, diferenciar entre pacientes con y sin debilidad en los músculos inspiratorios, o diferenciar entre grupo control con y sin carga inspiratoria, entre otros. Por lo tanto, no se puedo resumir evidencia en relación con estos elementos. Por otra parte, en las revisiones sistemáticas y meta-análisis incluidos se encuentra una gran variedad en los parámetros de los protocolos de los entrenamientos, heterogeneidad alta en los resultados y evidencia de baja calidad en los resultados de las variables en dos estudios incluidos según la herramienta GRADE. Estos elementos pueden contribuir al riesgo de sesgo, influencia y heterogeneidad de los resultados del EMI, por lo tanto, las conclusiones de este estudio deben ser tomadas con cautela. CONCLUSIONES El EMI presentó mejoras significativas sobre la capacidad aeróbica y la FMI en pacientes adultos (53-76 años) con IC (clase I-II-III NYHA) y FEVI reducida. La evidencia demuestra que el EMI es una intervención efectiva en la RC de pacientes con IC, especialmente para aquellos con debilidad muscular inspiratoria. Programas de intervención de EMI con una duración de 12 semanas reportaron mayores mejorías sobre la capacidad aeróbica y la FMI en comparación a programas de intervención de menor duración. Son necesarios más estudios que analicen y comparen los efectos de diferentes rangos en las características del EMI que permitan establecer conclusiones consistentes en la prescripción más beneficiosa de este entrenamiento para la RC de pacientes con IC. Contribución de los autores: Bruno Bizzozero Peroni: diseño del estudio, revisión bibliográfica, colección de datos, análisis de los datos, preparación del manuscrito, revisión y corrección del manuscrito. Valentina Díaz Goñi: revisión bibliográfica, colección de datos, análisis de los datos, preparación del manuscrito, revisión y corrección del manuscrito. Fondos: No se utilizaron fuentes de financiamiento para ayudar en la preparación de este artículo. Descargos de responsabilidad: Ninguno declarado. REFERENCIAS BIBLIOGRÁFICAS Agostoni, P., Corrà, U., Cattadori, G., Veglia, F., La Gioia, R., Scardovi, A. B., Emdin, M., Metra, M., Sinagra, G., Limongelli, G., Raimondo, R., Re, F., Guazzi, M., Belardinelli, R., Parati, G., Magrì, D., Fiorentini, C., Mezzani, A., Salvioni, E., … Passino, C. (2013). Metabolic exercise test data combined with cardiac and kidney indexes, the MECKI score: A multiparametric approach to heart failure prognosis. International Journal of Cardiology, 167(6), 2710–2718. https://doi.org/10.1016/j.ijcard.2012.06.113 Arena, R., Pinkstaff, S., Wheeler, E., Peberdy, M. A., Guazzi, M., & Myers, J. (2010). Neuromuscular Electrical Stimulation and Inspiratory Muscle Training as Potential Adjunctive Rehabilitation Options for Patients With Heart Failure. Journal of Cardiopulmonary Rehabilitation and Prevention, 30(4), 209–223. https://doi.org/10.1097/HCR.0b013e3181c56b78 Bard, R. L., Gillespie, B. W., Clarke, N. S., & Nicklas, J. M. (2008). Combining peak oxygen consumption and ventilatory efficiency in the prognostic assessment of patients with heart failure. International Journal of Cardiology, 123(2), 199–200. https://doi.org/10.1016/j.ijcard.2006.11.138 Becker, L., & Oxman, A. (2011). Chapter 22: Overviews of reviews en J. Higgins & S. Green (Eds.), Cochrane Handbook for Systematic Reviews of Interventions, Version 5.1.0 (pp. 614-639). The Cochrane Collaboration. https://es.cochrane.org/sites/es.cochrane.org/files/uploads/Manual_Cochrane_510_reduit.pdf Bissett, B., Leditschke, I. A., Paratz, J. D., & Boots, R. J. (2012). Respiratory Dysfunction in Ventilated Patients: Can Inspiratory Muscle Training Help? Anaesthesia and Intensive Care, 40(2), 236–246. https://doi.org/10.1177/0310057X1204000205 Cahalin, L. P., Arena, R., Guazzi, M., Myers, J., Cipriano, G., Chiappa, G., Lavie, C. J., & Forman, D. E. (2013). Inspiratory muscle training in heart disease and heart failure: a review of the literature with a focus on method of training and outcomes. Expert Review of Cardiovascular Therapy, 11(2), 161–177. https://doi.org/10.1586/erc.12.191 Callegaro, C. C., Martinez, D., Ribeiro, P. A. B., Brod, M., & Ribeiro, J. P. (2010). Augmented peripheral chemoreflex in patients with heart failure and inspiratory muscle weakness. Respiratory Physiology & Neurobiology, 171(1), 31–35. https://doi.org/10.1016/j.resp.2010.01.009 Chiappa, G. R., Roseguini, B. T., Vieira, P. J. C., Alves, C. N., Tavares, A., Winkelmann, E. R., Ferlin, E. L., Stein, R., & Ribeiro, J. P. (2008). Inspiratory Muscle Training Improves Blood Flow to Resting and Exercising Limbs in Patients With Chronic Heart Failure. Journal of the American College of Cardiology, 51(17), 1663–1671. https://doi.org/10.1016/j.jacc.2007.12.045 Chua, T. P., Anker, S. D., Harrington, D., & Coats, A. J. (1995). Inspiratory muscle strength is a determinant of maximum oxygen consumption in chronic heart failure. British Heart Journal, 74(4), 381–385. https://doi.org/10.1136/hrt.74.4.381 Ciapponi, A. (2018). AMSTAR-2: herramienta de evaluación crítica de revisiones sistemáticas de estudios de intervenciones de salud. Evidencia, actualización en la práctica ambulatoria, 21(1), 4-13. https://doi.org/10.51987/evidencia.v21i1.6834 Dall’Ago, P., Chiappa, G. R. S., Guths, H., Stein, R., & Ribeiro, J. P. (2006). Inspiratory muscle training in patients with heart failure and inspiratory muscle weakness: a randomized trial. Journal of the American College of Cardiology, 47(4), 757–763. https://doi.org/10.1016/j.jacc.2005.09.052 Evans, S. A., Watson, L., Hawkins, M., Cowley, A. J., Johnston, I. D. A., & Kinnear, W. J. (1995). Respiratory muscle strength in chronic heart failure. Thorax, 50(6), 625–628. https://doi.org/10.1136/thx.50.6.625 Giallauria, F., Piccioli, L., Vitale, G., & Sarullo, F. M. (2018). Exercise training in patients with chronic heart failure: A new challenge for Cardiac Rehabilitation Community. Monaldi Archives for Chest Disease = Archivio Monaldi per Le Malattie Del Torace, 88(3), 987. https://doi.org/10.4081/monaldi.2018.987 Giannitsi, S., Bougiakli, M., Bechlioulis, A., Kotsia, A., Michalis, L. K., & Naka, K. K. (2019). 6-minute walking test: a useful tool in the management of heart failure patients. Therapeutic Advances in Cardiovascular Disease, 13, 1-10. 175394471987008. https://doi.org/10.1177/1753944719870084 Gomes Neto, M., Ferrari, F., Helal, L., Lopes, A. A., Carvalho, V. O., & Stein, R. (2018). The impact of high-intensity inspiratory muscle training on exercise capacity and inspiratory muscle strength in heart failure with reduced ejection fraction: a systematic review and meta-analysis. Clinical Rehabilitation, 32(11), 1482–1492. https://pubmed.ncbi.nlm.nih.gov/29984598/ Haykowsky, M. J., Daniel, K. M., Bhella, P. S., Sarma, S., & Kitzman, D. W. (2016). Heart Failure: Exercise-Based Cardiac Rehabilitation: Who, When, and How Intense? The Canadian Journal of Cardiology, 32(10. Suppl 2), S382–S387. https://doi.org/10.1016/j.cjca.2016.06.001 Höllriegel, R., Winzer, E. B., Linke, A., Adams, V., Mangner, N., Sandri, M., Bowen, T. S., Hambrecht, R., Schuler, G., & Erbs, S. (2016). Long-Term Exercise Training in Patients With Advanced Chronic Heart Failure: sustained benefits on left ventricular performance and exercise capacity. Journal of Cardiopulmonary Rehabilitation and Prevention, 36(2), 117–124. https://doi.org/10.1097/HCR.0000000000000165 Kavanagh, T., Mertens, D. J., Hamm, L. F., Beyene, J., Kennedy, J., Corey, P., & Shephard, R. J. (2002). Prediction of long-term prognosis in 12 169 men referred for cardiac rehabilitation. Circulation, 106(6), 666–671. https://doi.org/10.1161/01.CIR.0000024413.15949.ED Laoutaris, I. D. (2018). The 'aerobic/resistance/inspiratory muscle training hypothesis in heart failure'. European Journal of Preventive Cardiology, 25(12), 1257–1262. https://doi.org/10.1177/2047487318776097 Laoutaris, I. D., Adamopoulos, S., Manginas, A., Panagiotakos, D. B., Cokkinos, D. V., & Dritsas, A. (2016). Inspiratory work capacity is more severely depressed than inspiratory muscle strength in patients with heart failure: Novel applications for inspiratory muscle training. International Journal of Cardiology, 221, 622–626. https://doi.org/10.1016/j.ijcard.2016.07.102 Le Jemtel, T. H., & Mancini, D. M. (2011). Chapter 19 - Alterations in Diaphragmatic and Skeletal Muscle en D. L. Mann (Ed.), Heart Failure: A Companion to Braunwald’s Heart Disease, (2ª Ed., pp. 300–311). Elsevier. https://doi.org/10.1016/B978-1-4160-5895-3.10019-1 Lin, S.J., McElfresh, J., Hall, B., Bloom, R., & Farrell, K. (2012). Inspiratory Muscle Training in Patients with Heart Failure: A Systematic Review. Cardiopulmonary Physical Therapy Journal, 23(3), 29–36. https://doi.org/10.1097/01823246-201223030-00005 Mancini, D. M., Henson, D., Manca, J. La, Donchez, L., & Levine, S. (1995). Benefit of Selective Respiratory Muscle Training on Exercise Capacity in Patients With Chronic Congestive Heart Failure. Circulation, 91(2), 320–329. https://doi.org/10.1161/01.CIR.91.2.320 Martínez S, A., Lisboa B, C., Jalil M, J., Muñoz D, V., Díaz P, O., Casanegra P, P., Corbalán H, R., Vásquez C, A. M., & Leiva G, A. (2001). Entrenamiento selectivo de los músculos respiratorios en pacientes con insuficiencia cardíaca crónica. Revista Médica de Chile, 129(2), 133–139. http://dx.doi.org/10.4067/S0034-98872001000200002 Miyagi, M., Kinugasa, Y., Sota, T., Yamada, K., Ishisugi, T., Hirai, M., Yanagihara, K., Haruki, N., Matsubara, K., Kato, M., & Yamamoto, K. (2018). Diaphragm Muscle Dysfunction in Patients With Heart Failure. Journal of Cardiac Failure, 24(4), 209–216. https://doi.org/10.1016/j.cardfail.2017.12.004 Moher, D., Liberati, A., Tetzlaff, J., Altman, D. G., & The PRISMA Group. (2009). Preferred Reporting Items for Systematic Reviews and Meta-Analyses: The PRISMA Statement. PLoS Medicine, 6(7), e1000097. https://doi.org/10.1371/journal.pmed.1000097 Montemezzo, D., Fregonezi, G. A., Pereira, D. A., Britto, R. R., & Reid, W. D. (2014). Influence of inspiratory muscle weakness on inspiratory muscle training responses in chronic heart failure patients: a systematic review and meta-analysis. Archives of Physical Medicine and Rehabilitation, 95(7), 1398–1407. https://doi.org/10.1016/j.apmr.2014.02.022 Myers, J., Prakash, M., Froelicher, V., Do, D., Partington, S., & Atwood, J. E. (2002). Exercise Capacity and Mortality among Men Referred for Exercise Testing. New England Journal of Medicine, 346(11), 793–801. https://doi.org/10.1056/NEJMoa011858 Pattyn, N., Coeckelberghs, E., Buys, R., Cornelissen, V. A., & Vanhees, L. (2014). Aerobic Interval Training vs. Moderate Continuous Training in Coronary Artery Disease Patients: A Systematic Review and Meta-Analysis. Sports Medicine, 44, 687–700. https://doi.org/10.1007/s40279-014-0158-x Plentz, R. D. M., Sbruzzi, G., Ribeiro, R. A., Ferreira, J. B., & Dal Lago, P. (2012). Treinamento muscular inspiratório em pacientes com insuficiência cardíaca: metanálise de estudos randomizados. Arquivos Brasileiros de Cardiologia, 99(2), 762–771. https://doi.org/10.1590/S0066-782X2012001100011 Ponikowski, P., Voors, A. A., Anker, S. D., Bueno, H., Cleland, J. G. F., Coats, A. J. S., Falk, V., González-Juanatey, J. R., Harjola, V.P., Jankowska, E. A., Jessup, M., Linde, C., Nihoyannopoulos, P., Parissis, J. T., Pieske, B., Riley, J. P., Rosano, G. M. C., Ruilope, L. M., Ruschitzka, F., … van der Meer, P. (2016). 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal, 37(27), 2129–2200. https://doi.org/10.1093/eurheartj/ehw128 Ramirez-Sarmiento, A., Orozco-Levi, M., Gëell, R., Barreiro, E., Hernandez, N., Mota, S., Sangenis, M., Broquetas, J. M., Casan, P., & Gea, J. (2002). Inspiratory muscle training in patients with chronic obstructive pulmonary disease: structural adaptation and physiologic outcomes. American Journal of Respiratory and Critical Care Medicine, 166(11), 1491–1497. https://doi.org/10.1164/rccm.200202-075OC Ribeiro, J. P., Chiappa, G. R., Neder, J. A., & Frankenstein, L. (2009). Respiratory muscle function and exercise intolerance in heart failure. Current Heart Failure Reports, 6(2), 95–101. https://doi.org/10.1007/s11897-009-0015-7 Sadek, Z., Salami, A., Joumaa, W. H., Awada, C., Ahmaidi, S., & Ramadan, W. (2018). Best mode of inspiratory muscle training in heart failure patients: a systematic review and meta-analysis. European Journal of Preventive Cardiology, 25(16), 1691–1701. https://doi.org/10.1177/2047487318792315 Sarkar, M., Bhardwaz, R., Madabhavi, I., & Modi, M. (2019). Physical signs in patients with chronic obstructive pulmonary disease. Lung India, 36(1), 38-47. https://doi.org/10.4103/lungindia.lungindia_145_18 Shea, B., Reeves, B., Wells, G., Thuku, M., Hamel, C., Moran, J., Moher, D., Tugwell, P., Welch, V., Kristjansson, E., & Henry, D. (2017). AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ, 358, j4008. https://doi.org/10.1136/bmj.j4008 Smart, N. A., Giallauria, F., & Dieberg, G. (2013). Efficacy of inspiratory muscle training in chronic heart failure patients: A systematic review and meta-analysis. International Journal of Cardiology, 167(4), 1502–1507. https://doi.org/10.1016/j.ijcard.2012.04.029 Smith, V., Devane, D., Begley, C. M., & Clarke, M. (2011). Methodology in conducting a systematic review of systematic reviews of healthcare interventions. BMC Medical Research Methodology, 11, 15. https://doi.org/10.1186/1471-2288-11-15 Swank, A. M., Horton, J., Fleg, J. L., Fonarow, G. C., Keteyian, S., Goldberg, L., Wolfel, G., Handberg, E. M., Bensimhon, D., Illiou, M.C., Vest, M., Ewald, G., Blackburn, G., Leifer, E., Cooper, L., Kraus, W. E., & HF-ACTION Investigators. (2012). Modest Increase in Peak VO2 Is Related to Better Clinical Outcomes in Chronic Heart Failure Patients: Results From Heart Failure and a Controlled Trial to Investigate Outcomes of Exercise Training. Circulation: Heart Failure, 5(5), 579–585. https://doi.org/10.1161/CIRCHEARTFAILURE.111.965186 Task Force Members, Montalescot, G., Sechtem, U., Achenbach, S., Andreotti, F., Arden, C., Budaj, A., Bugiardini, R., Crea, F., Cuisset, T., Di Mario, C., Ferreira, J. R., Gersh, B. J., Gitt, A. K., Hulot, J. S., Marx, N., Opie, L. H., Pfisterer, M., Prescott, E.,… Yildirir, A. (2013). 2013 ESC guidelines on the management of stable coronary artery disease. European Heart Journal, 34(38), 2949–3003. https://doi.org/10.1093/eurheartj/eht296 Vanhees, L., Rauch, B., Piepoli, M., van Buuren, F., Takken, T., Börjesson, M., Bjarnason-Wehrens, B., Doherty, P., Dugmore, D., Halle, M., & Writing Group of the EACPR. (2012). Importance of characteristics and modalities of physical activity and exercise in the management of cardiovascular health in individuals with cardiovascular disease (Part III). European Journal of Preventive Cardiology, 19(6), 1333–1356. https://doi.org/10.1177/2047487312437063 Wilches-Luna, E. C., Sandoval, L. M., & López, D. J. (2016). Confiabilidad intra e inter evaluador de la medición de la presión inspiratoria máxima (Pimáx) en treinta sujetos sanos de la ciudad de Cali. Ciencias de La Salud, 14(3), 329–338. https://doi.org/10.12804/revsalud14.03.2016.02 Wisløff, U., Støylen, A., Loennechen, J. P., Bruvold, M., Rognmo, Ø., Haram, P. M., Tjønna, A. E., Helgerud, J., Slørdahl, S. A., Lee, S. J., Videm, V., Bye, A., Smith, G. L., Najjar, S. M., Ellingsen, Ø., & Skjærpe, T. (2007). Superior Cardiovascular Effect of Aerobic Interval Training Versus Moderate Continuous Training in Heart Failure Patients. Circulation, 115(24), 3086–3094. https://doi.org/10.1161/CIRCULATIONAHA.106.675041 Witt, J. D., Guenette, J. A., Rupert, J. L., McKenzie, D. C., & Sheel, A. W. (2007). Inspiratory muscle training attenuates the human respiratory muscle metaboreflex. The Journal of Physiology, 584(3), 1019–1028. https://doi.org/10.1113/jphysiol.2007.140855 Wong, E., Selig, S., & Hare, D. L. (2011). Respiratory muscle dysfunction and training in chronic heart failure. Heart, Lung & Circulation, 20(5), 289–294. https://doi.org/10.1016/j.hlc.2011.01.009 Ziaeian, B., & Fonarow, G. C. (2016). Epidemiology and aetiology of heart failure. Nature Reviews. Cardiology, 13(6), 368–378. https://doi.org/10.1038/nrcardio.2016.25 Dirección para correspondencia
Mg. Bruno Bizzozero Peroni
Instituto Superior de Educación Física, Universidad de la República. Rivera, Uruguay. Dirección postal: Anollés 734. Código postal: 40000 ORCID: https://orcid.org/0000-0003-0614-5561 Contacto: brunobpru@gmail.com Recibido: 04-05-2021 Aceptado: 17-11-2021
|